概要:脂质纳米颗粒(LNPs)是一种具有均匀脂质核的脂囊泡,被广泛应用于小分子药物和核酸输送,最近因为在COVID-19 mRNA疫苗递送平台取得的显著成功引起了广泛的关注。然而,mRNA诱导的短暂蛋白表达的应用并不仅仅用于传染性疾病的疫苗领域,也为癌症疫苗、蛋白质替代疗法和罕见遗传疾病的基因编辑组件提供了新的途径。然而,未包覆的mRNA本身并不稳定,很容易由于核酸酶和自水解快速降解。经LNPs包覆的mRNA可以免受细胞外核糖核酸酶的影响,并有助于细胞内mRNA的递送。在这篇文章中,我们将讨论RNA递送所使用LNPs的核心特征。本文将聚焦于mRNA递送用LNPs;然而,也相应地列举了siRNA-LNP递送的例子,以突出核酸结构造成的共性和差异。首先,将介绍LNPs的概念,利用核酸作为治疗药物的优点和缺点,以及LNPs分子构成的一般推理;同时简要介绍了临床上基于LNPs的核酸治疗的最新成功经验。其次,阐述了LNP自组装的理论和方法。所有制备方法的共同理念是诱导核酸和带电脂质之间的静电相互作用,并通过疏水作用促进纳米颗粒的生长。第三,根据基本性质和用途对LNP进行成分分解,包括公认的分子设计标准、商业来源,对细胞内运输的影响,以及对LNPs性能的贡献。LNPs的关键成分之一是启动与内吞体膜的静电结合、并促进胞质释放的可电离脂质;然而,其他脂质成分的作用也不应忽视,因为它们与LNPs的稳定性、间隙和分布密切相关。第四,从整体上回顾了对RNA递送有重要影响的LNP结构属性,包括LNP的尺寸、电荷、内部结构、脂质封装、脂膜水合作用、稳定性和对生物大分子的亲和性;还将讨论这些属性的检测技术以及调控方法。最后,展望了RNA疗法的未来,并提出了LNP配方和优化领域中存在的一些问题。
1.引言
近年来,脂质纳米颗粒(LNPs)显示其在RNA疫苗和疗法中作为递送系统的的实用性。无包覆的RNA是一种带负电荷的亲水大分子,由于细胞膜的静电排斥,很难进入细胞,并被无所不在的核糖核酸酶(RNase)迅速降解。因此,它需要一个保护层以增加进入细胞内部机会。由于细胞膜主要由脂质构成,因此,使用脂质体包覆RNA可以使RNA更容易通过细胞膜并将其释放到细胞质中。为了实现这个目的,脂质体首先需要一个带正电的脂粒,可以附着在带负电的RNA上。然而,由永久性阳离子脂粒组成的脂质体会对带负电荷的细胞膜产生静电破坏从而引起细胞毒性。因此,脂质结构被进一步改进,通过酸性内溶酶体途径获得正电荷;LNP成分也扩展到了结构脂类(模拟细胞膜并屏蔽正电荷)和聚(乙二醇)-锚定脂类(防止LNPs聚集以及与生物环境的副反应)。从FDA批准了首个siRNA-LNP药物(Onpattro)和mRNA-LNP新冠疫苗(Comirnaty)以及Moderna新冠疫苗的紧急使用授权(EUA)等这些该领域的主要监管里程碑事件可以明显看出,基于LNP的核酸递送方法是安全的,适用于各种疗法。然而,目前还没有适合所有疾病的万能方案,因此LNP的优化工作依旧任重道远。本文将讨论用于选择RNA-LNP递送脂类所需的主要科学和制造概念。
2.制备
LNP的制备依赖于自组装能力,即脂质成分在分子间相互作用的基础上自发组装成纳米实体。LNP的形成从带负电荷的核酸和带正电荷的脂类之间的静电结合开始。然后,LNPs通过疏水性和脂质组分之间相互作用的范德华力增长。由于脂质的多样性、核酸的独特性及两者混合过程的瞬时性,对自组装的早期阶段及其对LNP最终性质的相关影响的表征仍然极具挑战。此外,LNP制造协议至少在两个方面影响产品的自组装: LNPs的均匀性和核酸负载效率。
LNP有多种制备方法,如脂膜泡挤出法、脂膜再水化、纳米沉淀法和微流体混合法。然而,通常的制备方法是将水和脂质组分快速混合。微流控技术以其良好的重复性而成为当前临床前研究的首选方法。新型微流控设备制造取得的进展使这种方法更容易实现,采用平行微流体通道或改进的传统方法(如移液管混合和t型混合器)等其他途径也可以实现LNPs的高通量制备。一般来讲,微流体混合有利于将亲水性部分封装到疏水的脂质核心中,但这一过程并不能严格需要核酸的参与。Kulkarni等报道,只要脂质核心形成,LNPs可以在T型混合器内与siRNA完成组装。总的来说,混合方式的特性可能会影响LNPs的组装效率和内部结构,而自组装过程的动力学因数则会决定最终的纳米结构。
3.配方
3.1阳离子和可电离脂质
阳离子脂质(CLs)和可电离脂质(ILs)通过静电相互作用启动自组装的第一步。含有CLs的脂质体仍被广泛用于核酸递送。然而,由于毒性问题和缺乏体内疗效,它们已被对pH敏感的ILs所取代。当被配制成LNPs时,ILs被设计成在生理pH下显示电中性,但在酸性核内体内则表现为带正电荷。这种pH适应的电离性使其功效提升同时毒性降低,从而更适合于核酸递送。这些脂类通常占配方中总脂类的30-50%。许多研究致力于微调ILs的属性,以进一步提高效率,特别是在难以触及的组织。CLs和ILs的整体结构可以分为三个部分:(1)头基、(2)连接体及(3)尾部(图1)。
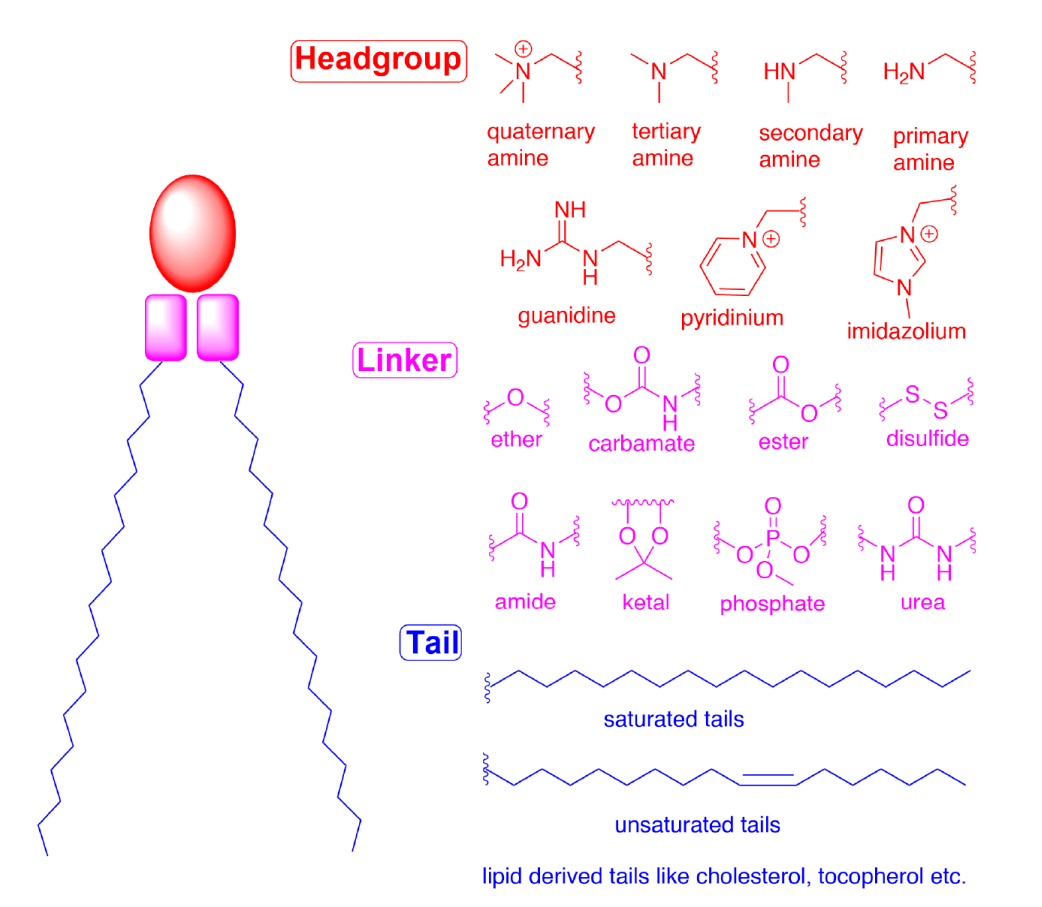
图1 CLs和ILs结构及组件(头基、连接体及尾部)示意图
头基 ILs的头基通常带正电荷。头基的大小和电荷密度对核酸包覆、LNP稳定、与细胞膜相互作用以及促进核内体中的释放有重要作用。ILs也可能有多个可电离的头基,尽管通常情况下只有一个。典型的基包括胺(从一级到四级)、胍和杂环群 (见图1)。临床应用的ILs(DLin-MC3-DMA、SM-102和ALC-0315;见图2)包含具有pH适应电离性的叔胺头基。ALC-0315和SM-102头基中也含有末端羟基,可以减少头基的水合作用,并提高其与核酸的氢键作用,可能会提高转染能力。
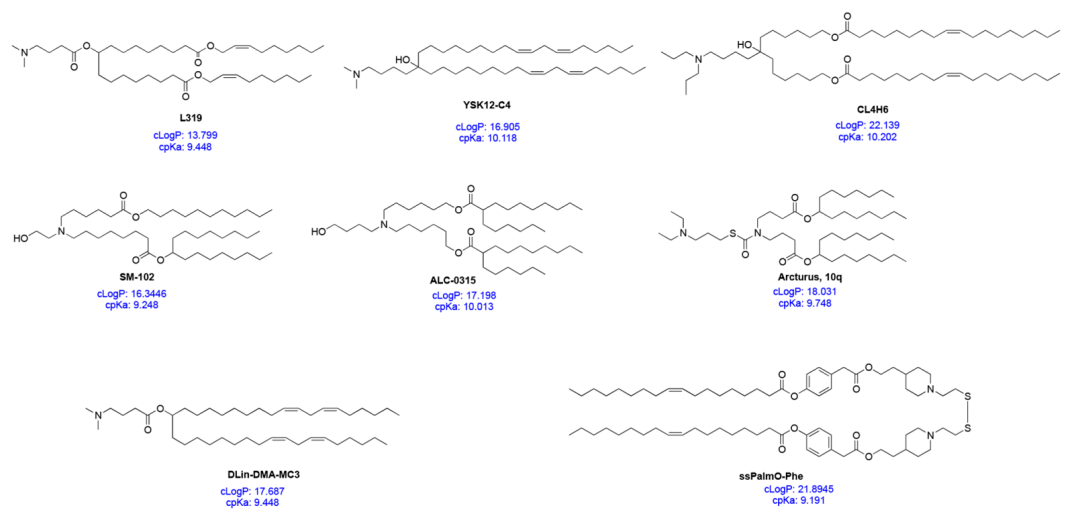
图2 特定ILs结构及cpKa和cLogP值
连接体 连接体通常连接头基与尾部,也可能包含在尾部内(SM-102和ALC-0315;见图2)。连接体会影响LNPs的稳定性、生物降解性、细胞毒性和转染效率。在CLs和ILs设计中使用的常用连接器如图1所示。ILs可能包含一个或多个连接体;然而,为了便于合成,大多数ILs只含有一种类型的连接体。连接体可分为不可生物降解型(如醚类和氨基甲酸酯类)和可生物降解型(如酯类、酰胺类和硫醇类)。生物可降解连接体由于可在体内被快速清除,通常被作为首选,以确保多次给药并减少潜在的副作用。值得注意的是,DLin-MC3-DMA,ALC-0315和SM-102都含有酯类连接体。对于SM-102,酯基团周围的修饰被证实会影响LNPs的清除、稳定性和转染效率。
尾部 疏水性的尾部会影响pKa、亲脂性、流动性和融合性,从而影响纳米颗粒的形成和效力。通常,一个IL包含1到4个由8到20个碳原子组成的饱和或不饱和的疏水性尾部。不饱和程度已被证明通过调节膜不稳定相关方面影响核酸的递送。DLin-MC3-DMA有两条亚油基尾部,而ALC-0315和SM-102包含两个假定为锥形的分叉饱和尾部,有助于对核内体膜的去稳定作用和核酸在细胞溶质的释放。
ILs可以被看作是多组分分子,其中的每个部分都需要被精确设计,以便安全、高效地包覆和递送核酸。从整体上理解ILs的特性也有助于设计下一代ILs。这些性质之一是计算出的ILs的pKa(cpKa),可以很容易地在硅中确定。常见ILs的cpKa值在9到10.5之间(图2)。最近的一项研究表明,cpKa极度接近IL的实际pKa. ILs的cpKa似乎影响相应LNP配方的整体pKa,这样当IL 的cpKa大约是8.5−10.5时,LNP的pKa值约为6−7。IL的cpKa和LNP的pKa之间的差值似乎是固定的,约等于2 - 4个单位。因此,cpKa可以作为新ILs产品设计的指导工具。ILs的另外两个不太被关注的性质是cLogP和cLogD值,它们分别代表分子在非电离态和电离态下的亲油性。在最近的一项研究中,Rajappan等考察了pKa、cpKa和cLogD对LNPs递送siRNA的影响,发现cLogD在10 - 14范围内的脂质效果最好。因为一些常见的ILs的cLogP值在15−20范围内 (图2),在设计下一代ILs时也应考虑其亲油性性。由于电离度(cpKa)和亲油性(cLogP) IL可以影响从最初的与核酸形成复杂结构到最终纳米粒子形成以及核酸递送的整个流程,在合成IL前同时考虑这两个参数可能会极大的推动高效IL的发现。不过,需要更多的研究来印证这一观点。
除了传统的CLs和ILs外,还有一些两性离子脂类的例子。在最近的一项研究中,Liu等人合成了一个名为iPhos的超过500种两性离子脂质的库。这些iPhos由一个胺基、短疏水性尾部和一个磷酸盐连接体组成。研究认为,带负电荷的磷酸基促进了膜融合,并导致核内体释放。最优的9A1P9的各种配方可以优先将目标核酸输送到肝脏和肺部。
综上所述,ILs各部分的性质影响整体配方和生物学特性。过去50年间,为设计出理想的IL已经有了许多系统的研究。其中一些ILs已经被FDA批准用于基因制剂的递送。然而,设计能够在非肝靶上高效无毒地输送不同类型的基因制剂的ILs仍需大量研究。对ILs合成有更多兴趣的读者可以参考一篇优秀的相关综述。
3.2固醇类
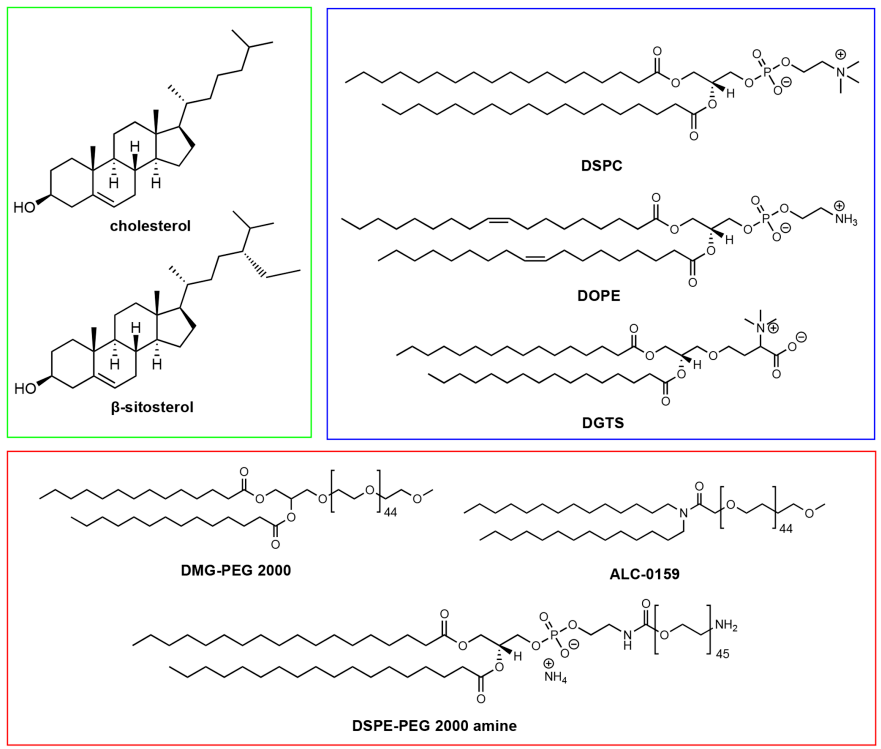
图3 LNP配方中使用的固醇(绿色)、磷脂(蓝色)和PEG脂质 (红色)举例
3.3磷脂类
磷脂有助于核酸的封装和LNPs稳定性的提高。与其他脂类成分相比,它们的研究相对较少,通常只占配方中总脂类的10 - 20%。磷脂因为可以自发地组织成脂质双分子层,并且具有较高的相变温度从而确保LNPs的膜稳定性而被用作结构脂质。磷脂位于LNPs的外围,就像细胞膜一样。这些脂类通常是半合成的,例如,磷脂酰胆碱通常来自蛋黄和大豆等天然来源,可以通过化学修饰使其包含脂肪酸尾部。二硬脂酰磷脂酰胆碱 (DSPC)(见图3)是一种临床批准的LNPs结构脂质,用于如siRNA治疗(Onpattro)和针对SARS-CoV-2的mRNA疫苗。DSPC在结构上由磷脂酰胆碱头基和两个饱和18碳尾组成,形成一个紧密堆积的脂质双分子层。在LNPs中,它主要位于纳米颗粒表面,同时在纳米颗粒核中少量存在。二油酰磷脂酰乙醇胺(DOPE)是另一种经常用于LNPs临床前研究的磷脂。由于尾部不饱和,DOPE不仅形成流动性更好的脂质层,而且具有形成六边形II (HII)相结构的内在能力。HII相结构被认为能促进脂质膜与核内体膜的膜融合,进而使核酸制剂在胞质内释放。多项研究表明,与DSPC相比,DOPE可以提高率磷脂基LNPs中RNA的转染效率。近期,Zhang等人报道称,DOPE可导致C12-200 LNPs在肝脏内的聚集,而DSPC会导致静脉给药时脾积聚,证明了结构脂质对LNP生物分布的影响。我们还发现,用天然糖脂替代MC3基LNPs中的DSPC会影响mRNA转染,来自植物的膜脂--高丝氨酸(DGTS)(见图3),可以根据给药途径表现出不同的转染效率。总之,这些研究突出了结构脂质在LNPs介导的RNA递送中的重要性。
3.4嵌PEG脂质
嵌PEG脂质(PEG-lipids,见图3)是控制LNPs半衰期和细胞摄入的一个重要组成部分。在LNP组装过程中,PEG链由于其亲水性和大体积而位于纳米颗粒的外壳中。与其他纳米载体一样,PEG为LNPs提供了外部聚合物层,以阻碍血清蛋白和单核吞噬细胞系统的吸附,延长体内循环时间。PEG还可以防止纳米颗粒在储存过程以及血液中的聚集。此外,PEG脂质的含量可能决定颗粒的大小。PEG脂质的另一个潜在用途是功能化LNP的表面,使LNPs与配体或生物大分子结合成为可能。例如,Singh等使用DSPE-PEG-胺通过NHS/EDC化学共轭结合透明质酸来靶向治疗肿瘤,Parhiz等使用DSPE-PEG-马来酰亚胺通过SATA-马来酰亚胺化学共轭结合抗体。虽然PEG有助于LNP的稳定性和生物偶联,但其解吸对细胞转染也至关重要。PEG从LNPs中的脱落可使血清蛋白(如载脂蛋白和白蛋白)产生调理作用,这是LNPs发生受体介导内吞作用的关键效应物。Akinc等人证明ApoE与LNPs结合后,导致低密度脂蛋白受体(LDLR)介导的肝细胞内化。由于PEG脂质抑制ApoE与LNPs的结合,过量的PEG 脂质会对LNPs的细胞摄入和转染产生不利影响。含有较少PEG脂质的LNPs由于更容易与ApoE结合表现出更高的酸递送效率。PEG脂类脂质锚的长度也是决定解吸速率的重要因素。Mui等报道了PEG从LNP的脱落与PEG-脂质锚定长度成反比,这是因为PEG-脂质与LNP膜之间的疏水相互作用随着PEG-脂质锚定长度的增加而增加。Suzuki等提出,PEG脱落的速度也可能影响抗-PEG抗体的产生,并反复给药会引起并发症。静脉给药LNP配方中PEG脂质的含量很少超过2%;然而,密集的聚乙二醇层可能有利于达到肝外靶点。Lee等的研究结果显示,相较2.5%的PEG脂质含量,5%的PEG脂质含量时LNPs在肿瘤中的积累更量高于,Lokugamage等的研究表明,PEG脂质对雾化LNPs的递送至关重要。因此,LNPs中PEG脂质的含量和种类可能需要根据临床需求谨慎调整。
4.性质
LNPs的平均尺寸和尺寸分布是各种应用中LNP质量和适用性的重要初始决定因素,这些性质通常用动态光散射(DLS)来研究。一般来说,LNP的最佳尺寸为20 - 200nm,因为这个尺寸使其在流体(如血液和淋巴)中足够稳定,同时能够穿过间隙。LNP的尺寸通常通过改变PEG脂质的量或混合参数(如流速和体积比)来调节。LNPs的尺寸可能会影响其内吞、生物分布、降解和清除,不同的应用可能需要不同的粒径。例如,45 nm的siRNA LNPs在皮下给药时最有效,而80 nm 的siRNA LNPs在小鼠静脉给药时最有效。然而,对啮齿动物和非人灵长类动物中各种粒径mRNA-LNP的对比表明,非人灵长类动物肌肉注射时对LNPs粒径不太敏感。
LNP依靠表面电荷与细胞膜和生物环境进行相互作用。由于细胞膜带负电荷,表面带负电荷的LNPs会被细胞膜排斥从而不被细胞吸收。另一方面,带正电荷LNPs可能会直接破坏细胞膜,引起细胞毒性。这就凸显了可电离脂质在LNP设计中的重要性:最初,含有可电离脂质的LNP是中性的,可以避免任何不必要的静电相互作用,但在酸性内体pH环境下会带正电荷。LNPs的表面电荷通常用zeta电位测量来评估,该技术通常用于评估胶体聚集,尽管没有严格的分类,但如果zeta电位落在-20和+20 mV之间,则认为表面电荷较弱。调整LNPs总表面电荷的一种常见方法是调整N/P比或者说电离脂质(N代表阳离子胺)与核酸(P代表阴离子磷酸盐)的比值。Carrasco等认为,增加含有可电离脂质KC2的LNPs中的N/P比可以增加表面电荷和封装效率。有趣的是,在LNPs中加入永久带电的脂质时可能在不增加表面电荷的情况下改变优先摄取的器官。Cheng等基于脂质电荷在小鼠中实现了选择性器官靶向(SORT):向LNP配方中添加带正电荷的脂质可实现肺组织的优先转染,而带负电荷的脂质则将转染导向脾脏。
脂质封包可能会影响从膜的水化和变形能力到细胞摄取和核酸释放等许多参数。最近的一篇综述总结了形成脂质囊泡所需的脂质体的基础知识。简单地说,每种脂质都可以用一个封包参数来描述,该参数取决于脂质极性“头”和非极性“尾”所占的体积。结构平衡的脂质形成柱状结构和层状相,而“不平衡”结构则形成六方、立方和胶束相。倒置的六方相(HII)表现出最显著的脂膜融合促进作用。到目前为止,非层状相的可控制备在RNA-LNP递送领域仍然是相对少见的,纳米立方液晶是最突出的例子。然而,LNPs在暴露于环境诱因时可能发生结构变化。Heyes等利用核磁共振波谱(P NMR)研究了含有一系列具有不同脂尾的阳离子脂质的脂质颗粒的相变行为,发现层状到倒置六方相转变温度(TBH)较低的脂质具有更好的融合促进能力,这一点在基因沉默效率上得到了证明。同样,其中一个膜不稳定理论提出,当可电离脂质暴露于晚期核内体的酸性pH时,可电离脂质与核内体膜内磷脂之间的静电相互作用会导致膜破裂。Liu等最近的一项工作基于这一概念,报道了利用核磁共振波谱得到的一种新型可电离脂质暴露于核内体模拟物时倒置六方相形成的证据。虽然pH诱导关联是脂质材料最常见的机制,但在我们最近的综述中讨论了其他导致核内体膜不稳定的路径。
由于脂质相和整体极性的不同,脂膜可能会捕获水从而改变膜的流动性或变形性,这可能会影响脂膜融合。膜水合作用也可能影响对pH的潜在响应,而pH通常作为启动核酸释放的一个重要环境诱因。LNP在其生命周期中所涉及的pH波动如图4所示。当LNPs进入细胞内空间时,它们被束缚在核内体中,而核内体在成熟为溶酶体时会逐渐酸化。因此,脂质膜内较高的含水量可能会影响酸化动力学,并有加速膜的失稳。Koitabashi等通过Laurdan实验研究了siRNA-LNPs中pH值对脂膜稳定性的影响,发现膜水合作用与基因沉默效率呈正相关;然而,该研究并未关注酸化动力学。关于膜水合有一个有意思的现象,核磁共振波谱结果表明,siRNA-LNPs比相同配方的mRNA-LNPs的含水量更少,这可能是因为亲水RNA链的长度更长。Carrasco等进一步证明了这些观点,他们发现低N/P比的KC2 LNPs单个纳米颗粒中包含更多的mRNA和脂质,并且有较高的介电常数,认为低N/P比的LNPs比高N/P比的LNPs更易水合。更高的RNA载量也会使转染得到改善。因此,mRNA-LNPs可能对环境变化更敏感,尽管pH敏感性的变化可能与生物过程的时间尺度无关。暴露在生物环境中的重组进一步使LNP壳水化的问题变得复杂。
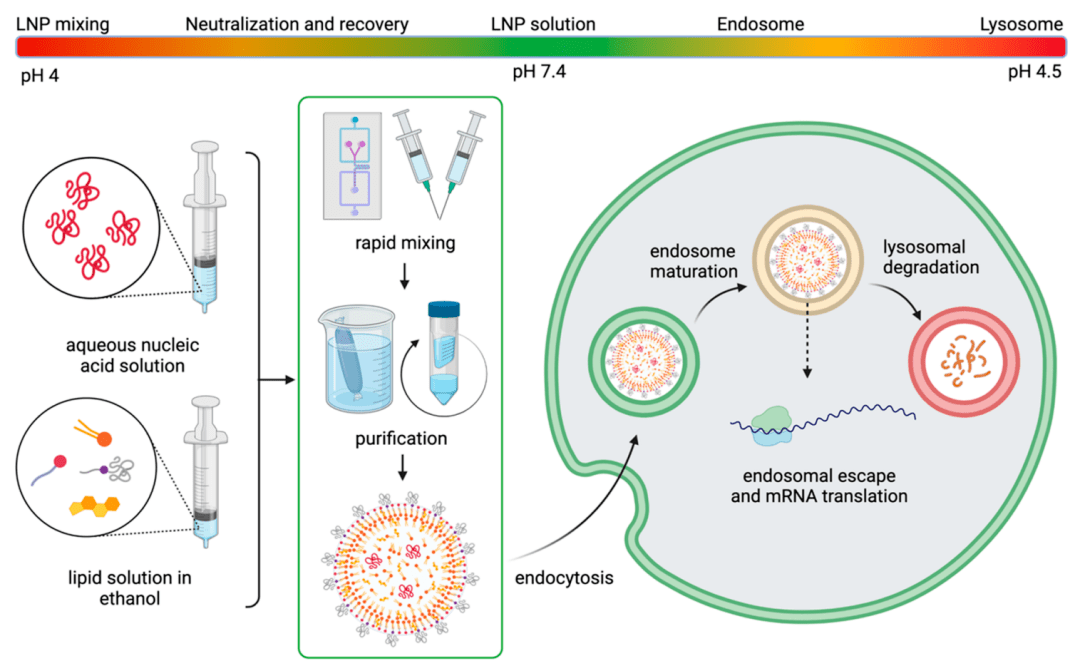
图4 LNP生命周期中涉及的pH变化
LNPs固有的水环境也对其长期稳定构成威胁。纯核酸在环境条件下可通过外源RNase降解或自水解迅速恶化。虽然LNPs可以保护核酸免受酶降解,但它们容易因为热力学因素(如最小化相分离)聚集,可能导致纳米颗粒融合时核酸的丢失,最终影响转染效率。低温保存和冻干可以保护RNA,但是冰结晶会损伤LNPs,尽管加入蔗糖等低温保护剂似乎可以缓解这个问题。有趣的是,LNPs可能会根据储存条件改变优先摄取其的器官,这可能是它们重组的结果。从实践的角度来看,最近开发的针对COVID-19的mRNA-LNP疫苗为RNA疗法创建了物流基础设施,这可能会消除关于LNP稳定性、存储和运输的许多担忧。这些疫苗拥有在冷冻温度(-20°C)下长达6个月的以及室温下长达30天的长期稳定性,极大地推动了这些突破性治疗的普及。值得注意的是,辉瑞/BioNTech和Moderna疫苗有着不同的存储要求,这表明LNP配方的变化可能会显著改变其核酸亲和力和LNP稳定性。由于目前还没有建立针对这些非晶材料的加速稳定性测试的方法,这意味着,LNP稳定性只能在离散时间点进行经验评估,差示扫描量热法(DSC)等方法可能对LNP退化提供有价值的参考。最后,预测基于LNP的RNA疗法的下游特性需要我们对LNP的自组装过程有更深的理解。
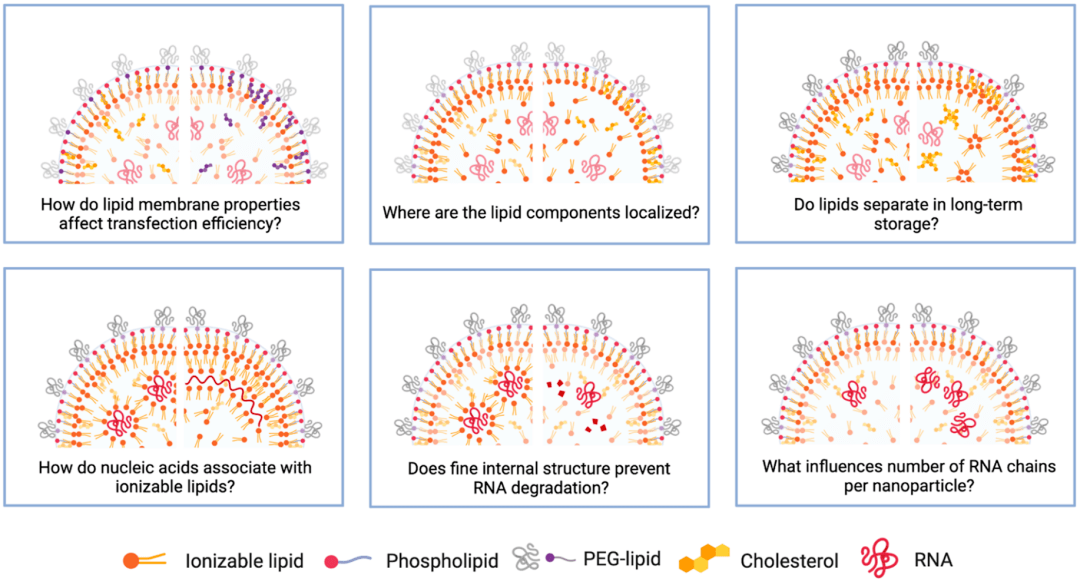
图5 LNP结构待解决问题
5.结论和展望
LNPs是一种高度可定制的核酸载体,在mRNA疫苗中显示出巨大的潜力。我们也不应忽视它们在治疗罕见疾病和癌症方面的可能价值。mRNA治疗可以帮助产生治疗性蛋白来恢复受损组织或器官的功能。全球开展了大量的科学研究来设计和细化LNPs的单个成分,以便高效和安全地递送所关注的核酸。然而,LNP科学方兴未艾,还有许多悬而未决的问题,图5中列出了其中的一些。毫无疑问,公众对mRNA疫苗的持续高涨的兴趣将激励这一领域的研究工作,我们谨慎乐观地认为,我们正在见证纳米医学的新时代。
原文来源:Chemistry of Lipid Nanoparticles for RNA Delivery.Acc Chem Res. 2022 Jan 4;55(1):2-12.